本文摘自<常春月刊>508期
文/文/張金堅(乳癌防治基金會董事長)
外泌體(exosome 或稱 Small Extracellular Vesicles,sEVs)是透過細胞內的胞內體
(endosome)路徑生合成的內源性奈米級(直徑30-200mm)細胞外囊泡(或稱小胞外體,small Extracellular Vesicles,/sEVs)(圖一),其大小相當於人類頭髮直徑的百萬分之一,含有各類RNA(如miRNAs、mRNAs、IncRNAs等)、蛋白質、脂質、小分子代謝物等,存在於血液、尿液、唾液、淚液、母乳和細胞培養基等生物體液中。起初這種物質被視為細胞廢棄物形同垃圾,但如今科學界已廣泛認同外泌體作為細胞間通信媒介的重要角色。
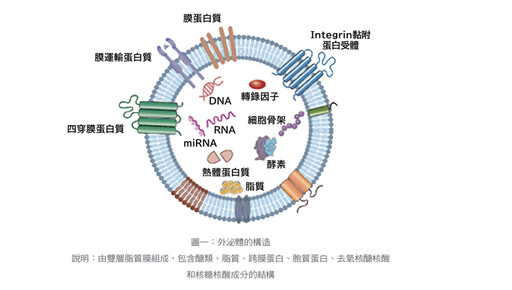
泌體由細胞經由胞吐(exocytosis)釋放後,能傳遞含有複雜因子的信號給其他細胞。其傳遞方式有三種;融合作用(fusion)、接受體與配位體交互作用(receptor-ligand interaction)或胞吞作用(endocytosis),進而調控這些細胞的功能。(圖二)

外泌體的來源
於1981年由美國國家神經、溝通障礙及中風研究所(National Institute of Neurological and Communicative Disorders and Stroke, NINCDS)特拉姆斯博士(Eberhard Trams)領導的研究團隊首次使用「外泌體」一詞,描述細胞表面釋放的細胞外囊泡(extracellular vesicles,EVs)。1983年外泌體首次在體外培養的綿羊紅細胞上清液中被發現,且多種細胞都能分泌。
2013年諾貝爾生理學或醫學獎授予美國科學家詹姆斯羅斯曼(圖三左)和蘭迪謝克曼(圖三中)以及德國科學家托馬斯蘇德霍夫(圖三右),以表彰他們發現細胞內部囊泡運輸調控機制,因而才引起各方科學家的注意,而成為研究的熱門話題。

人體幾乎所有細胞都能產生外泌體,這些外泌體不僅可由細胞釋放,也能從如心包積液(pericardial effusion)、羊水(amniotic fluid)等體液中分泌出來。多種類型的細胞,如間質幹細胞 (mesenchymal stem cells, MSCs)、上皮細胞 (epithelial cell)、巨噬細胞 (macrophage, mφ) 等,均能分泌外泌體。
此外,外泌體幾乎存在於所有體液中,包括羊水、尿液、腦脊液、唾液及淚液等。間質幹細胞是一種非造血、多功能的成體幹細胞,可以從多種組織,如骨髓、臍帶、脂肪組織中分離獲取。
外泌體的作用及在精準醫學領域的應用
由於外泌體具有再生能力以及免疫抑制特性,推動了間質幹細胞(MSC)應用於多種疾病治療的臨床試驗。一些研究顯示:在各種損傷和疾病模型中,MSC 分泌的外泌體可以取代基於MSC 的幹細胞療法。
另外多項研究顯示:基於外泌體具有內源性、生物相容性和多功能特性,可參與機體免疫調節、血管新生、細胞增殖及凋亡等各項環節,進而發揮組織修復的作用,到目前為止,具有下列五大作用。
❶作用一:免疫調節
間質幹細胞外泌體可降低巨噬細胞趨化蛋白(chemokine)CX3CL1 及腫瘤壞死因子(tumor necrosis factor, TNF)的表達,同時上調白血球介素-10(interleukin-10),降低局部炎症反應,發揮免疫調節的作用。同時幹細胞外泌體可調節機體免疫,促進受損組織修復。
❷作用二:促進血管新生
多項研究顯示:由幹細胞生成的幹細胞源性外泌體(stem cell derived exosome)具備與幹細胞相當的心臟保護效力,能增進血管生成、降低細胞凋亡,以及減輕發炎損害。
外泌體因其優異的穩定性及低受體細胞突變與免疫排斥風險,被視為心血管疾病很有潛力的治療方法。
2015年研究顯示:間質幹細胞源性外泌體(mesenchymal stem cells derived exosome, MSC-Exos)移植,能顯著提升心肌細胞存活、對抗損傷、促進新血管生成及改善心臟功能。其他研究亦證實其具有抗發炎、抗凋亡及促進心肌再生的作用。
❸作用三:促進細胞增殖
MSC衍生的外泌體(MSC-Exos)在傷口癒合和心肌梗塞方面展現出顯著效果,尤其是胎盤臍帶MSC分泌的外泌體,對傷口癒合和組織再生至關重要。
細胞損傷時,凋亡細胞會釋放促進有絲分裂信號,進而使體內器官再生,作為補償細胞的損失。凋亡過程中,死亡細胞會誘導鄰近細胞增殖,以恢復體內平衡,但凋亡細胞與鄰近細胞間的訊號傳導機制,仍有待進一步研究。
近 期 , 芝 加 哥 拉 什 大 學 ( R u s h University) 醫學中心的研究人員發現:凋亡細胞釋放的含CT10激酶(kinase)調節因子(CT10 regulator of kinase 1, CrkI)的微泡,進而誘導鄰近細胞增殖,用電子顯微鏡可觀察到。這些純化的囊泡在體外和體內實驗中,均能有效刺激細胞增殖。
❹作用四:組織修復與再生
皮膚傷口通常需要精細組織修復,癒合不良會產生疤痕,若發生壞死,不僅會破壞皮膚的屏障功能,而且對疼痛、溫度和觸覺的感知,也會發生變化。因此,尋找一種替代方法來加速傷口癒合是非常重要。
科學家發現:臍帶間質幹細胞來源的外泌體能抑制α平滑肌肌動蛋白(alpha smooth muscle actin, α-SMA)的表達和減少第一型膠原蛋白(collagen)沉積,可抑制皮膚傷口癒合過程中肌纖維母細胞(myo-fibroblasts)的分化,從而減少疤痕形成,促進皮膚傷口癒合。
❺作用五:藥物載體
外泌體與細胞膜融合可將所攜帶的物質和信號,傳遞到受體細胞並改變其生物學功能,外泌體是奈米大小藥物遞送或基因治療的潛在載體。此外,外泌體作為功能性核糖體核糖核酸(ribonucleic acid, RNA)和蛋白質的天然載體,其可以利用這些囊泡遞送各種核糖核酸分子、胜肽(peptide)和合成藥物,以達到更精確的治療效果。
基於上述五大作用,在當今強調個人化的精準醫學的領域,其應用範圍既深且廣,大約歸納下列四項應用。(如圖四)
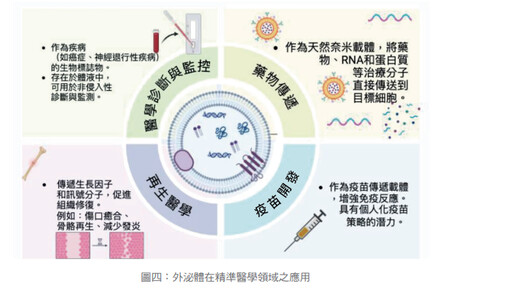
精準醫學領域4應用
❶疾病診斷和監測
所謂液體檢體是一種利用血液、尿液、唾液或其他體液進行疾病檢測的方法,相較於傳統的組織檢體,然而液體檢體具有低侵入性、低風險、方便、低成本,且能夠多次重複操作的優勢。在癌症診斷方面,研究顯示,外泌體可以攜帶腫瘤細胞釋放的DNA、RNA、蛋白質、代謝物,及其他分子來參與癌症生成及惡化的過程,因此利用這些分子可以作為早期癌症形成或是癌轉移的生物標記,除了癌症診斷,外泌體在其他疾病如心血管疾病、神經退行性疾病和感染性疾病中的應用,也在積極探索中。
此外,外泌體還可以用來監測治療效果和疾病復發的風險。由於外泌體可以動態反映腫瘤或病變組織的狀況,通過定期檢測病人血液中的外泌體內容物,醫師可以評估其治療效果,及早發現疾病復發的跡象,將來在個人化的精準醫療上扮演著關鍵角色。
❷藥物遞送
外泌體其屬於細胞天然性來源,使其更容易被人體細胞接受,甚至可以減少免疫系統的排斥反應。此外,外泌體具有高度的穩定性與在體內環境中的壽命,使其成為一個理想的藥物載體。
外泌體作為藥物載體,目前在癌症的應用方面最受關注,由於外泌體具有靶向傳遞的特性,它們可以精確地將抗癌藥物直接遞送到腫瘤細胞中,從而大幅提高藥物的有效濃度,並減少對正常的健康細胞的毒性影響。除了抗癌藥物的遞送外,外泌體還在其他疾病的治療中也展現其潛力。例如,在神經退行性疾病的治療中,外泌體可以用來遞送神經保護性藥物穿越血腦屏障,這是一般傳統藥物遞送系統所難以達到的。
總而言之,外泌體在藥物遞送和診斷中的應用潛力無限。隨著技術的不斷進步,未來外泌體有望成為治療多種疾病的有效工具,從而改變目前的治療模式,提供更精準和個人化的醫療服務。
❸再生醫學
在再生醫學領域,來自幹細胞所分泌的外泌體具有極大的應用功能,特別是在組織修復和再生醫療方面。這些外泌體不僅促進了細胞間的溝通,還能調節免疫反應,為受損組織的修復創造有利環境或是給予活化相關生化活性。許多的研究已經顯示,在心肌梗塞、中風和慢性傷口等病症的治療中,幹細胞外泌體表現出明顯的治療效果。總結來說,外泌體在再生醫學中的應用前景誠可謂廣闊且深遠。隨著研究的不斷深入,外泌體有望成為治療多種組織損傷和退化性疾病的有效工具,並為個人化醫療和精準治療提供新的途徑。
❹基因療法及疫苗開發
由於外泌體可以被天然或工程化地設計用來攜帶和遞送各種類型的遺傳物質,包括DNA、RNA、siRNA和反義寡核苷酸(Antisense Oligonucleotide,ASO),它們已經扮演著基因療法研究中的熱門工具。此外,外泌體可以同時攜帶多個基因或調控分子,從而針對多個靶點進行治療。這一多重遞送能力使外泌體成為治療複雜疾病的理想工具。隨著更多臨床試驗的進行,外泌體有望成為治療遺傳性疾病、癌症及其他複雜疾病的核心工具,為病人提供更有效、更安全的治療選擇。
由於外泌體的天然來源和奈米級大,它們可以有效地在活體內的組織間及環境中呈現抗原,從而誘導免疫反應。這一特性使得外泌體疫苗在增強免疫反應的同時,顯著減少了傳統疫苗相關的副作用和免疫反應過強的風險。除了在傳染病預防的應用外,外泌體可以被設計為表現出腫瘤相關抗原,從而誘發病人的免疫系統針對腫瘤細胞進行攻擊。這種方法有望克服腫瘤免疫逃逸的問題。隨著技術的進步和臨床試驗的進展,外泌體疫苗可能成為下一代疫苗技術的核心,為全球公共衛生提供更強有力的保護手段。
基於上述外泌體的多重作用及在精準醫學的應用潛力,外泌體相關應用的市場成長相當迅速,根據CMT(Coherent Market Insights)的報告,已從2025年的2億2千2百萬美元,預期至2032年將達12億8千4百萬元,複合年均增長率(CAGR)高達28.5%。(如圖五)

目前外泌體面臨的挑戰
❶分離和純化
外泌體的分離和純化目前主要依賴於超高速離心、密度梯度離心、凝集沉澱、免疫親和性分離、超過濾、粒徑大小層析法等技術。然而,這些方法各有優缺點。
例如,超高速離心是目前最常用的方法之一,但它往往需要長時間運行,且容易導致外泌體的損壞或功能性分子的流失。相比之下,免疫親和性分離方法能夠針對特定的外泌體膜蛋白進行分離,從而提高純度,但其成本高且操作繁瑣,不易大規模應用。總結來說,儘管外泌體作為治療工具的潛力巨大,但在分離和純化技術上的挑戰,仍然是一個需要解決的關鍵問題。
❷法規障礙
由於外泌體的異質性,來自不同批次的外泌體產品,可能在組成、功能和效果上存在變異。這就必須在生產過程中實施嚴格的品質和品管的控制流程,以確保每一批次的外泌體產品在物理特性和生物活性方面保持一致。
其次,安全性評估也是監管機構審查外泌體療法的關鍵步驟之一。因此,必須對外泌體產品進行全面的臨床前研究,以評估其在動物模型中的毒性、免疫反應和長期安全性。此外,在進入臨床試驗階段之前,還需要進行廣泛的質量測試和生物安全評估。
總體而言,儘管外泌體療法顯現出廣闊的應用前景,但其臨床轉化之路仍充滿了法規上的挑戰。只有在監管機構和研究者共同努力下,制定出清晰而科學的指導方針,外泌體療法才能在確保安全性和有效性的前提下,順利進入臨床應用,最終達到造福於病人。
在台灣,2023年3月31日,由前衛福部部長林奏延教授及台大沈湯龍教授發起,聯合台灣胞外體學會(TSEV)、台灣研發型生技新藥發展協會(TRPMA)
及台灣精準醫療產業協會(PMIA)共同組成推動。
成立了台灣外泌體產學聯盟,主要倡議政府重視並鼓勵外泌體研發,促進學界與產業界對接。當前再生醫療及醫美市場仍以非人源性動植物外泌體為主,以醫美化粧品為例,多以植物外泌體為主,成本低,萃取過程最為穩定,目前植物外泌體來自蘆薈、葡萄柚、青花菜、葡萄、人參、玫瑰等,主要用於護膚修護等產品,及至2024年3月衛福部正式公告修正後的「化妝品禁止使用成分表」,在化妝品中使用人源胞外體,經個案審查通過後可開放使用。讓台灣繼南韓及日本開放後,成為第三個有法規與指引,明確許可的人源外泌體的國家。
緊接著衛福部在同年6月發布的「再生醫療雙法」,已將外泌體產品納管,由衛生福利部食品藥物管理署(Taiwan Food And Drug Administration,TFDA)監管。此外,考量細胞外囊泡(外泌體)製劑目前已有許多產學研發單位投入相關項目開發,而台灣尚未發布針對此類產品法規,財團法人醫藥品查驗中心於2025年1月16日提供「細胞外囊泡製劑製造與管制之研發策略指導原則-第二版」盼能提供產業於研發階段的策略參考,及闡述品質相關法規科學建議。
台灣外泌體產業法規尚未完備,有賴產官學研各方先進磋商溝通取得共識,並以嚴謹務實的態度推進相關療法研究,衷心盼望外泌體產業在台灣發光發熱,為生技產業成長注入一股新力量。
❸可擴展性的挑戰
品質控制是確保外泌體產品的一致性和安全性的關鍵。在大規模生產中,品質控制系統需要涵蓋從細胞庫建立、細胞培養、外泌體分離純化到最終產品測試的每一個環節。這要求建立一套標準化的質量控制指標和檢測方法,確保外泌體的物理化學性質、功能性分子和生物活性在不同批次間保持一致。此外,質量控制還應該包括對潛在污染物(如細菌、病毒、生物毒素和其他細胞外囊泡)的檢測,以確保外泌體產品的純度和安全性。
最後,自動化生產系統不僅能提高生產效率,降低人為錯誤的風險,還能有效降低生產成本,從而使外泌體療法更具經濟可行性。高通量技術的應用可以快速篩選和優化生產條件,加速新產品的研發進程,並且在臨床需求增加的情況下,能夠快速擴大生產規模,滿足市場需求。
❹深化基礎生物學研究的挑戰
外泌體的生物學研究仍處於發展階段,尚有許多基礎科學和技術的問題仍未解決。隨著對外泌體生合成機制、內含物質選擇載入機制和與目標細胞/組織的作用機制仍要深入了解,未來才有希望通過基因工程和化學修飾技術,實現對外泌體功能的精確調控,從而提高其在臨床治療中的應用效果和安全性。這將為外泌體療法開創更加光明的前景,也將推動生物醫學領域的重大突破。
結語
外泌體作為一種奈米級細胞外囊泡,因其穩定性、低免疫抗原性和標靶遞送能力,已在疾病診斷、藥物遞送、再生醫學等領域,展示出廣泛的應用潛力。此外,外泌體還可作為疫苗開發的載體,展示出對傳染病和癌症的預防與治療的堅厚實力。未來,外泌體在個人化醫療和基因療法中的應用前景廣闊可期。
然而,外泌體的臨床轉化面臨諸多挑戰,包括分離和純化技術的標準化、產品質量的一致性,以及法規條文的制定。此外,將外泌體生產規模擴大到臨床使用,還需解決技術上如細胞培養和生產自動化的困難。隨著研究的深入和技術的進步,這些挑戰有望被克服,使外泌體療法成為未來醫學的重要地位,為病人提供更精確和有效的治療選擇。
(圖片來源:Dreamstime/典匠影像)